植物对于内外界环境变化的适应能力,决定了其是否能够顺利生存。植物环境适应性的决定因素之一,在于对内外信号的感受以及有效传递。受体激酶(Receptor-like kinase, RLK)是植物感受环境信号的重要受体,固着生长的植物,在环境适应的进化中,RLK显著扩增,表明RLK至关重要。RLK功能重要性等同于动物中的G蛋白偶联受体GPCR。一般认为,RLKs通过细胞外配体结合结构域(ECD)感知和识别配体分子,经跨膜结构域(TM),诱导胞内核心激酶结构域(KD)发生磷酸化,形成激活构象,而后招募特定的细胞内底物,启动下游信号转导。目前对ECD-配体和KD-底物相互作用都取得了不少进展,但RLKs如何形成激活构象,并启动底物磷酸化的精细生化与结构机制相对空白。
近日,beat365官方网站明振华/湖南大学生物学院于峰合作团队在Plant Communications在线发表了题为Structural and biochemical basis of Arabidopsis FERONIA receptor kinase-mediated early signaling initiation的研究论文,该论文以RLK典型成员FERONIA (FER)为模型,结合结构生物学和生物化学等手段,解析了非磷酸化形式的FER胞内核心激酶(FER-KD)晶体结构,发现FER-KD维持在一个激活构象的状态。与RLK需要磷酸化后方可形成激活构象的传统观点不同,该研究揭示了一类新的RLK构象调控机制。
一般激酶在非磷酸化前,采用一类“αC-out”和/或“DFG-out”的失活构象,经磷酸化诱导形成“αC-in”和“DFG-in”的激活构象。研究人员获得了非磷酸化的FER-KD与ADP和Mg2+复合物(FER-KD-ADP-Mg2+)的晶体结构,发现未磷酸化的FER-KD采用“αC-in”、“DFG-in”的激活构象。为了确认FER-KD激活构象的形成确实不依赖于磷酸化,研究人员进一步解析了FER不能发生自磷酸化的突变体K565R以及自磷酸化能力部分降低的突变体S525A与核苷酸以及Mg2+复合物的晶体结构,发现这两类FER-KD的突变体均为激活构象形式。表明非磷酸化的FER-KD可以形成激酶激活状态下的典型构象。
研究人员进一步研究了FER激酶自磷酸化及底物磷酸化(转磷酸化)的分子机理。发现FER-KD具有很强的自磷酸化能力,自磷酸化采用分子间的催化机制。FER-KD的自磷酸化会显著增强酶分子的二聚化,形成正反馈调控以加速其自磷酸化激活。研究人员还通过磷酸化质谱手段,鉴定了FER-KD关键的自磷酸化位点。
在底物磷酸化方面,研究人员选用之前报道的FER磷酸化底物GRP7和MYC2,评估了FER-KD的转磷酸化活性和特异性。实验发现FER-KD的转磷酸化比自磷酸化在时间上相对延迟,FER的自磷酸化增强转磷酸化能力,表明FER-KD自磷酸化对于底物磷酸化的启动至关重要。
该研究提出了FER激酶激活并调控底物磷酸化的模型。在缺乏RALF配体的情况下,FER处于非磷酸化状态,但是维持在激活构象。这种激活形式的构象可能有助于RLK快速启动自磷酸化或便于与底物互作(但不磷酸化底物),配体RALFs的结合诱导FER发生自磷酸化,自磷酸化后的FER-KD获得底物磷酸化能力,通过磷酸化底物完成信号传递。
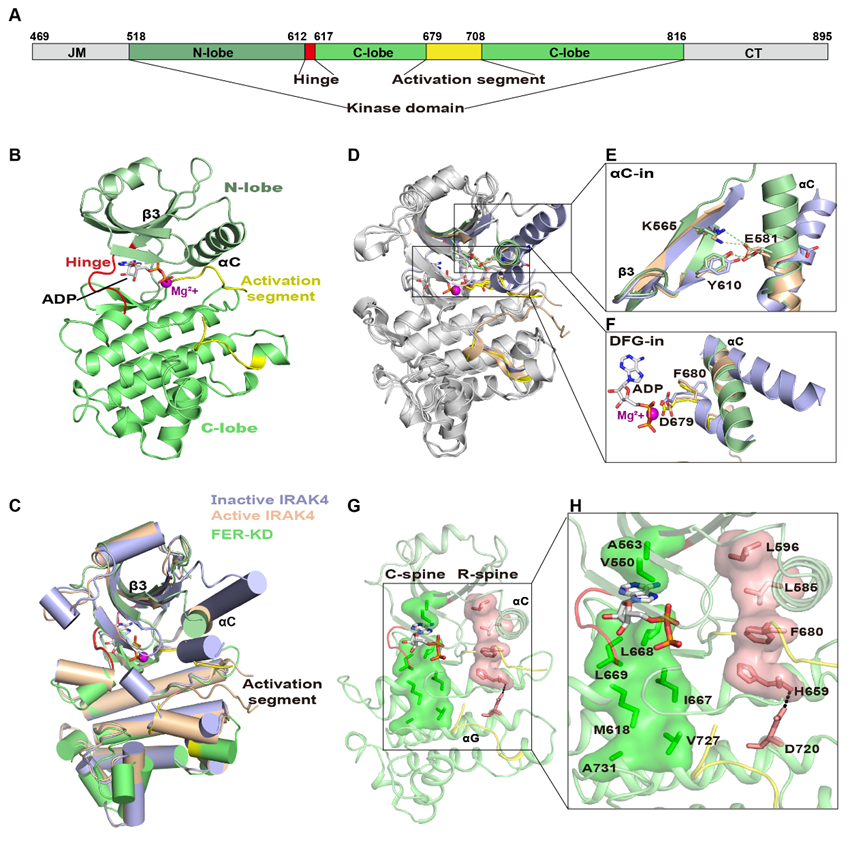
图1. FER-KD与ADP和Mg2+复合物的整体结构
综上,该研究拓宽了人们对受体激酶构象调控机制的认识,为理解RLK信号启动的早期过程提供了重要线索。
beat365官方网站博士研究生孔彦琼和湖南大学生物学院副研究员陈佳为本文的共同第一作者,我室明振华教授和湖南大学于峰教授为共同通讯作者。湖南大学郑何平教授等人为本研究提供了诸多的支持与指导,上海同步辐射光源周欢博士在结构解析方面提供了技术支持。该研究得到了国家自然科学基金、广西自然科学基金、中国博士后科学基金等资助。